Science Park 老化とテロメア
Science Park 老化とテロメア
極寒の海に生きる長寿の巨人たち~北極鯨と西隠田鮫の驚異的な寿命~
師走の風が頬を撫で、空気に静かな緊張感が漂う季節となりました。
寒さが深まるこの時期、私たちの身体も心も、自然のリズムに寄り添うように静かに変化していきます。
今号では、そんな冬の静けさにふさわしく、「極寒の海に生きる長寿の巨人たち」と題し、北極圏に生きる動物たちの驚くべき寿命に焦点を当てます。
科学が解き明かしつつある“長寿”の秘密。 それは、私たちの老化や健康寿命にも静かに問いかけてくるものです。それでは、本編をお楽しみください。

北極圏に生息する北極鯨(Balaena mysticetus)は、現存する哺乳類の中で最も長寿とされる種のひとつであり、その寿命は200年以上に達すると考えられています。2007年、アラスカ沖でイヌピアット・エスキモーによって捕獲された個体の体内から、1880年頃に製造された爆弾付きのモリが発見され、その個体が約130歳であることが判明しました。この発見は、北極鯨の驚異的な長寿を裏付ける実例として世界中の注目を集めました。
北極鯨は体長最大20メートル、体重80トン以上に達し、特に雌の方が大きくなる傾向があります。極寒の海に適応するため、脂肪層は平均で43〜50cmと非常に厚く、氷を突き破って呼吸する能力を持つことでも知られています。
その長寿の秘密については長らく謎とされてきましたが、近年の研究により、DNA修復能力の高さが鍵のひとつである可能性が示唆されています。2025年に発表されたNature誌の研究では、北極鯨の細胞において低温で活性化されるDNA修復タンパク質が特定されました。このタンパク質は、二本鎖DNAの損傷を効率的に修復する能力を持ち、老化やがんの発症を抑制する役割を果たしていると考えられています。さらに、このタンパク質をヒト細胞に導入したところ、DNA修復能力が向上し、ショウジョウバエの寿命延長にも寄与したという報告があります。
一方、西隠田鮫(Greenland Shark, Somniosus microcephalus)は、脊椎動物の中で最も長寿であることが科学的に確認されています。2016年にScience誌に掲載された研究では、28匹の雌の西隠田鮫の眼の水晶体の中心核を放射性炭素年代測定により分析。その結果、平均寿命は少なくとも272歳と推定され、最大で392±120歳と見積もられた個体も確認されました。この方法は、眼の水晶体に含まれる出生時に形成されるタンパク質が加齢によって変化しないことを利用したもので、極めて信頼性の高い年齢推定手法とされています。
西隠田鮫の長寿の要因としては、極端に遅い成長速度(年間1cm未満)と、深海の低温環境に適応した極めて低い代謝率が挙げられています。これにより、細胞の損傷や酸化ストレスの蓄積が抑えられ、老化の進行が遅くなると考えられています。
これらの長寿動物の研究は、人間の老化メカニズムの理解や健康寿命の延伸にもつながる可能性があり、近年注目が高まっています。たとえば、北極鯨のDNA修復機構や、西隠田鮫の代謝制御の仕組みを解明することで、がんや加齢性疾患の予防・治療法の開発に貢献することが期待されています。
さらに、無脊椎動物に目を向けると、北大西洋に生息するアイスランドガイ(Arctica islandica)という二枚貝が、507歳という記録的な寿命を持つことが知られています。2025年に発表されたゲノム解析研究では、この貝が非常に効率的な酸化ストレス応答とタンパク質維持機構を持つことが示され、長寿の分子基盤の解明に向けた重要なモデル生物とされています。
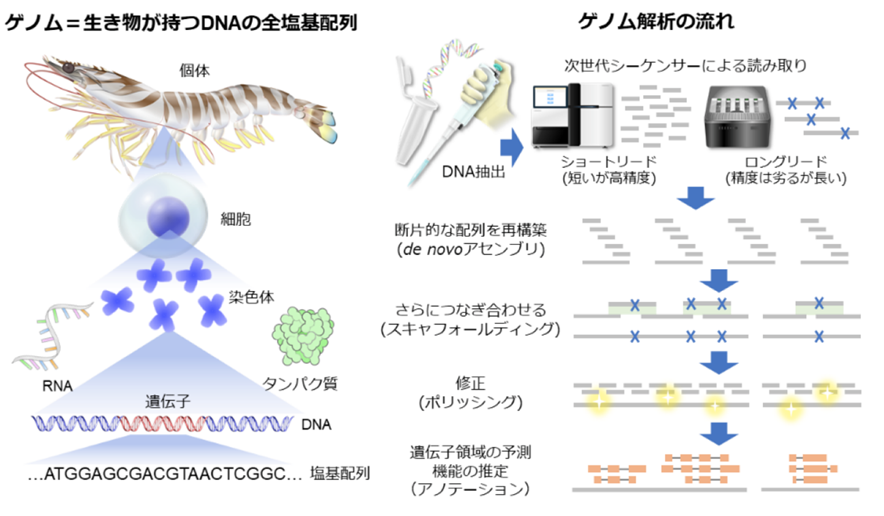
出典: 東京海洋大学ゲノム科学研究室
これらの動物は、人間と何が違うのでしょう。
生き物はみな、年を重ねていきます。けれど、そのスピードは種によって大きく異なります。 中には、驚くほどゆっくりと老いる生き物や、寿命がどれほど長いのかさえ分からないような生物も存在します。

中には、驚くほどゆっくりと老いる生き物や、寿命の限界がいまだに分からないような生物も存在します。
たとえば、クロコダイルやアリゲーター。私はこれまでにクロコダイルの免疫や抗菌性に関する研究に取り組んで飼育・畜産・研究を行っている香川県にある「農業活性化法人 喜望峰」に何度か飼育所を訪れましたが、飼育員たちは口をそろえてこう語ります。 「このクロコダイルは私たちより年上ですが、まるで若者のように元気いっぱいで、信じられないくらいエネルギッシュですよ」と。。。
実際、南アフリカの保護施設で暮らすクロコダイル「ヘンリー」は、124歳を迎えた今も健康で、これまでに1万匹以上の子を残してきたと報告されています。年齢を重ねても活動的で、繁殖能力も衰えず、見た目にも老化の兆しがほとんど見られない。こうした“老化しない”ように見える生物の存在は、私たちに「老化とは何か?」という根源的な問いを投げかけます。
クロコダイルの驚異的な老化耐性の背景には、いくつかの生物学的な特徴があります。まず注目されているのが、彼らの免疫と代謝の仕組みです。クロコダイルは、腐敗した肉を食べたり、重金属や放射線にさらされた環境でも生き延びることができる、極めて高い耐性を持つ生物です。近年の研究では、彼らの腸内マイクロバイオーム(腸内細菌群)が、感染症や炎症に対する強力な防御機構を支えている可能性が示されています。
特に注目されているのが、クロコダイルの血液に含まれる抗菌性タンパク質です。これらのタンパク質は、傷口の治癒を促進し、白血球の増加を引き起こすことで、感染症の拡大を防ぎます。ある研究では、細菌にさらされたクロコダイルの体内で、わずか1時間以内に免疫反応が活性化されたことが確認されました。
また、クロコダイルは変温動物であり、体温を外部環境に依存しています。これにより代謝速度が非常に低く、細胞の酸化ストレスやDNA損傷の蓄積が抑えられ、組織の摩耗が遅くなると考えられています。これは、老化の進行を遅らせる要因のひとつとされ、“代謝と寿命の関係”を示す重要なモデルとなっています。
こうした老化の進み方の違いは、クロコダイルに限った話ではありません。比較生物学の研究では、哺乳類の中でも、ネズミのように代謝が速く短命な種と、コウモリやゾウのように代謝が遅く長寿な種が存在することが明らかになっています。この違いは、単に体の大きさや生活環境だけでなく、遺伝子発現のパターンや細胞の修復能力にも関係しています。
2023年にCell誌で発表された研究では、複数の哺乳類種の遺伝子発現を比較し、長寿種に共通する“老化耐性の遺伝子群”が存在することが示されました。これらの遺伝子は、DNA修復、抗酸化応答、タンパク質の品質管理などに関与しており、老化の進行を抑える働きを持つと考えられています。
こうした知見は、クロコダイルやアリゲーターのような長寿種の研究が、人間の老化メカニズムの解明や健康寿命の延伸に貢献する可能性を示しています。実際、現在では、クロコダイルの腸内細菌や免疫機構をヒトに応用する研究も始まっています。たとえば、クロコダイル由来の抗菌ペプチドをヒト細胞に導入し、感染症耐性を高める試みや、腸内マイクロバイオームの移植による老化抑制モデルの構築などが検討されています。
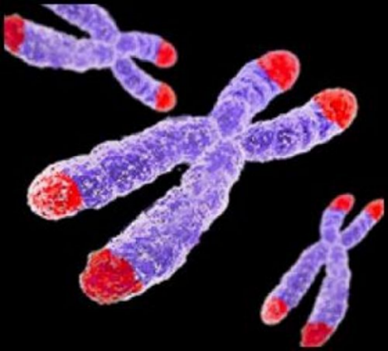
老化の根本的な仕組みとして、近年ますます注目されているのが、細胞内の「テロメア」と呼ばれる構造です。テロメアは、染色体の末端に存在する反復配列で、細胞分裂のたびに少しずつ短縮していきます。やがて限界に達すると、細胞は分裂を停止し、細胞老化(senescence)やアポトーシスを引き起こすと考えられています。まさに、テロメアは“細胞の体内時計”とも言える存在なのです。
このテロメアの摩耗を抑えたり、再生させたりすることができれば、老化の進行を遅らせ、加齢関連疾患の予防や治療につながるのではないか——。この仮説のもと、世界中で研究が加速しています。
2024年、テキサス大学MDアンダーソンがんセンターの研究チームは、テロメラーゼ逆転写酵素(TERT)の発現を回復させる小分子化合物を発見し、マウスモデルにおいて老化の複数の兆候を逆転させることに成功しました。この治療により、記憶力や筋力の改善、炎症の抑制、新しい神経細胞の形成促進などが確認され、アルツハイマー病や心疾患、がんなどの加齢関連疾患への応用が期待されています。
さらに、TERTは単にテロメアを延長するだけでなく、神経新生、学習・記憶、炎症制御に関わる遺伝子群の転写因子としても機能することが明らかになりつつあります。これは、老化が単一の経路ではなく、複数の分子ネットワークの変調によって進行することを示唆する重要な発見です。
現在、テロメア研究と並行して、遺伝子編集技術の進化も、老化制御の可能性を大きく広げています。2025年現在、CRISPR-Cas9をはじめとする遺伝子編集技術は、がんや遺伝性疾患の治療において臨床応用が進んでおり、“老化そのものを標的とする治療”も現実味を帯びてきました。
たとえば、CRISPR 2.0(次世代型CRISPR)では、従来のDNA切断を伴う編集に加え、ベースエディティングやプライムエディティングといった、より精密で副作用の少ない手法が登場しています。これにより、老化関連遺伝子の変異や発現異常を、細胞レベルで安全かつ正確に修正することが可能になりつつあります。また、2025年には、CRISPRを用いた個別化医療の第一例として、生後6か月の乳児に対するオーダーメイド遺伝子治療が成功したことが報告されました。この治療では、患者の遺伝子変異に合わせて設計されたCRISPR治療薬が、わずか半年で開発・投与され、症状の進行を食い止めることに成功。これは、将来的に老化関連遺伝子の個別修正が可能になることを示す画期的な一歩です。
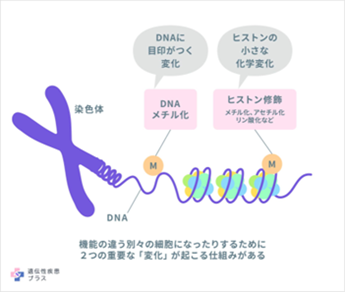
老化の制御を目指すには、単一の遺伝子だけでなく、全体のゲノムネットワークの理解が不可欠です。2025年の研究では、シングルセル・マルチオミクス解析を用いて、老化に関わる遺伝子発現、エピジェネティクス、代謝経路、クロマチン構造の変化を統合的に解析する試みが進んでいます。このような技術により、個人ごとの“生物学的年齢”を可視化し、老化の進行度を分子レベルで評価することが可能になりつつあります。これにより、老化の早期兆候を検出し、個別化された介入を行う「プレシジョン・エイジング医療」が現実のものとなりつつあります。
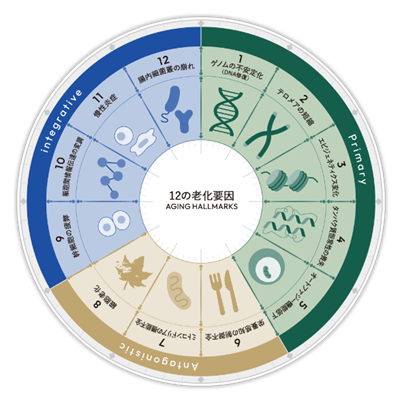
さらに、老化の9つのホールマーク(genomic instability, telomere attrition, epigenetic alterationsなど)を標的とした多面的な治療戦略が提案されており、遺伝子編集、再生医療、エピジェネティック・リプログラミングなどが組み合わされることで、老化そのものを“治療可能なプロセス”として捉える時代が到来しつつあります。
老化は、もはや“避けられない自然現象”ではなく、制御可能な生物学的プロセスとして再定義されつつあります。テロメアの保護、TERTの再活性化、そして遺伝子編集による老化関連経路の修復。これらの技術は、健康寿命の延伸だけでなく、加齢性疾患の予防や治療、さらには生物学的年齢の巻き戻しという未来を現実のものにしようとしています。
もちろん、倫理的・社会的な課題も山積していますが、科学の進歩は確実に、私たちの“時間”の概念を変えようとしています。 老化を理解することは、未来の医療を設計すること。 そしてその鍵は、私たちの細胞の奥深く、遺伝子の中に静かに息づいているのです。
学生の頃、私は思っていました。 「地球上には何百年も生きる動物がいるのだから、いつか人間も同じように長生きできるはずだ」と。 そして今、まさにその可能性が現実味を帯びてきています。 それを支えているのが、ナノテクノロジーという科学の最前線です。
ナノテクノロジーとは、1ナノメートル(10億分の1メートル)という極小の世界を操作する技術。この分野では、細胞よりもはるかに小さな“ナノロボット”と呼ばれる超小型の医療デバイスの開発が進められています。これらは金属製の機械ではなく、有機物やDNA、タンパク質などで構成された生体適合性の高い構造体で、体内で拒絶反応を起こしにくいのが特徴です。
将来的には、これらのナノロボットが血液中に注入され、体内を自由に移動しながら、壊れた細胞を修復したり、テロメアの摩耗を検知して再生を促したりすることが期待されています。つまり、老化の進行を遅らせるだけでなく、がんや遺伝子の突然変異といった深刻な疾患の予防や治療にも応用できる可能性があるのです。
実際、2025年の研究では、がん細胞を標的にしたナノロボットの開発が大きく進展しています。たとえば、インドの研究チームは、ナノロボットによるがん治療の可能性をまとめたレビューで、ナノロボットが血流を通じて腫瘍に到達し、薬剤をピンポイントで投与することで、正常な細胞へのダメージを最小限に抑えられることを示しました[1]。さらに、治療効果のリアルタイムモニタリングや再発の早期検出にも応用できるとされています。
また、カナダのモントリオール工科大学では、MRI装置を使ってナノロボットを生体内で誘導し、肝臓の腫瘍に薬剤を届ける実験が行われました。豚を用いたこの研究では、重力と磁場を利用してナノロボットを目的地に集めることに成功し、将来的な臨床応用への道筋が見えてきました[3]。
さらに、セレンナノ粒子を用いたがん治療も注目されています。2025年、中国の研究チームは、セレンナノ粒子にがん抑制因子(MDM2阻害剤)を搭載し、大腸がんモデルにおいてp53経路を再活性化させることに成功しました[4]。この治療は、がん細胞のアポトーシスを誘導するだけでなく、腫瘍免疫環境を再構築し、免疫細胞の活性化を促すという二重の効果を持ち、今後の免疫療法との併用にも期待が寄せられています。
こうしたナノロボットは、単に薬を運ぶだけでなく、細胞内の異常を検知し、必要な分子を放出して修復を促す“細胞内の医師”のような存在です。将来的には、テロメアの短縮を検知してTERTの発現を促すナノロボットや、DNA損傷をリアルタイムで修復する分子機械の開発も視野に入っています。
今この瞬間にも、ナノテクノロジーを活用した治療法は、従来の手術や薬物療法では対応できなかった疾患に対して、新たな可能性を切り拓いています。 皺取りや関節の修復といった美容・整形分野はもちろん、致命的な感染症やがん、さらには老化そのものに挑む医療技術が、すでに臨床応用の一歩手前にまで迫っているのです。
すでに述べたように、テロメアは細胞の“体内時計”として老化に深く関わっています。近年はその再生や保護を通じた老化制御の研究が加速しています。やがて限界に達すると、細胞は分裂を停止し、細胞老化(senescence)やアポトーシスを引き起こすと考えられています。まさに、テロメアは“細胞の体内時計”とも言える存在なのです。
このテロメアの摩耗を抑えたり、再生させたりすることができれば、老化の進行を遅らせ、加齢関連疾患の予防や治療につながるのではないか——。この仮説のもと、世界中で研究が加速しています。
前述のTERT研究に加え…マウスモデルにおいて老化の複数の兆候を逆転させることに成功しました[1]。この治療により、記憶力や筋力の改善、炎症の抑制、新しい神経細胞の形成促進などが確認され、アルツハイマー病や心疾患、がんなどの加齢関連疾患への応用が期待されています。
さらに、TERTは単にテロメアを延長するだけでなく、神経新生、学習・記憶、炎症制御に関わる遺伝子群の転写因子としても機能することが明らかになりつつあります。これは、老化が単一の経路ではなく、複数の分子ネットワークの変調によって進行することを示唆する重要な発見です。
遺伝子編集がもたらす“老化の書き換え”
テロメア研究と並行して、遺伝子編集技術の進化も、老化制御の可能性を大きく広げています。2025年現在、CRISPR-Cas9をはじめとする遺伝子編集技術は、がんや遺伝性疾患の治療において臨床応用が進んでおり、“老化そのものを標的とする治療”も現実味を帯びてきました。
たとえば、CRISPR 2.0(次世代型CRISPR)では、従来のDNA切断を伴う編集に加え、ベースエディティングやプライムエディティングといった、より精密で副作用の少ない手法が登場しています[5]。これにより、老化関連遺伝子の変異や発現異常を、細胞レベルで安全かつ正確に修正することが可能になりつつあります。
また、2025年には、CRISPRを用いた個別化医療の第一例として、生後6か月の乳児に対するオーダーメイド遺伝子治療が成功したことが報告されました。この治療では、患者の遺伝子変異に合わせて設計されたCRISPR治療薬が、わずか半年で開発・投与され、症状の進行を食い止めることに成功。これは、将来的に老化関連遺伝子の個別修正が可能になることを示す画期的な一歩です。
老化の制御を目指すには、単一の遺伝子だけでなく、全体のゲノムネットワークの理解が不可欠です。2025年の研究では、シングルセル・マルチオミクス解析を用いて、老化に関わる遺伝子発現、エピジェネティクス、代謝経路、クロマチン構造の変化を統合的に解析する試みが進んでいます。
このような技術により、個人ごとの“生物学的年齢”を可視化し、老化の進行度を分子レベルで評価することが可能になりつつあります。これにより、老化の早期兆候を検出し、個別化された介入を行う「プレシジョン・エイジング医療」が現実のものとなりつつあります[7]。
さらに、老化の9つのホールマーク(genomic instability, telomere attrition, epigenetic alterationsなど)を標的とした多面的な治療戦略が提案されており、遺伝子編集、再生医療、エピジェネティック・リプログラミングなどが組み合わされることで、老化そのものを“治療可能なプロセス”として捉える時代が到来しつつあります。
老化は、もはや“避けられない自然現象”ではなく、制御可能な生物学的プロセスとして再定義されつつあります。テロメアの保護、TERTの再活性化、そして遺伝子編集による老化関連経路の修復。これらの技術は、健康寿命の延伸だけでなく、加齢性疾患の予防や治療、さらには生物学的年齢の巻き戻しという未来を現実のものにしようとしています。
もちろん、倫理的・社会的な課題も山積していますが、科学の進歩は確実に、私たちの“時間”の概念を変えようとしています。 老化を理解することは、未来の医療を設計すること。 そしてその鍵は、私たちの細胞の奥深く、遺伝子の中に静かに息づいているのです。
ナノロボットが拓く未来医療:細胞修復から老化制御へ
ナノテクノロジーとは、1ナノメートル(10億分の1メートル)という極小の世界を操作する技術。この分野では、細胞よりもはるかに小さな“ナノロボット”と呼ばれる超小型の医療デバイスの開発が進められています。これらは金属製の機械ではなく、有機物やDNA、タンパク質などで構成された生体適合性の高い構造体で、体内で拒絶反応を起こしにくいのが特徴です。
将来的には、これらのナノロボットが血液中に注入され、体内を自由に移動しながら、壊れた細胞を修復したり、テロメアの摩耗を検知して再生を促したりすることが期待されています。つまり、老化の進行を遅らせるだけでなく、がんや遺伝子の突然変異といった深刻な疾患の予防や治療に用できる可能性があるのです。
実際、2025年の研究では、がん細胞を標的にしたナノロボットの開発が大きく進展しています。たとえば、インドの研究チームは、ナノロボットによるがん治療の可能性をまとめたレビューで、ナノロボットが血流を通じて腫瘍に到達し、薬剤をピンポイントで投与することで、正常な細胞へのダメージを最小限に抑えられることを示しました[1]。さらに、治療効果のリアルタイムモニタリングや再発の早期検出にも応用できるとされています。
また、カナダのモントリオール工科大学では、MRI装置を使ってナノロボットを生体内で誘導し、肝臓の腫瘍に薬剤を届ける実験が行われました。豚を用いたこの研究では、重力と磁場を利用してナノロボットを目的地に集めることに成功し、将来的な臨床応用への道筋が見えてきました[3]。
さらに、セレンナノ粒子を用いたがん治療も注目されています。2025年、中国の研究チームは、セレンナノ粒子にがん抑制因子(MDM2阻害剤)を搭載し、大腸がんモデルにおいてp53経路を再活性化させることに成功しました[4]。この治療は、がん細胞のアポトーシスを誘導するだけでなく、腫瘍免疫環境を再構築し、免疫細胞の活性化を促すという二重の効果を持ち、今後の免疫療法との併用にも期待が寄せられています。
こうしたナノロボットは、単に薬を運ぶだけでなく、細胞内の異常を検知し、必要な分子を放出して修復を促す“細胞内の医師”のような存在です。将来的には、テロメアの短縮を検知してTERTの発現を促すナノロボットや、DNA損傷をリアルタイムで修復する分子機械の開発も視野に入っています。

今この瞬間にも、ナノテクノロジーを活用した治療法は、従来の手術や薬物療法では対応できなかった疾患に対して、新たな可能性を切り拓いています。 皺取りや関節の修復といった美容・整形分野はもちろん、致命的な感染症やがん、さらには老化そのものに挑む医療技術が、すでに臨床応用の一歩手前にまで迫っているのです。
参考文献
- Gerhard, G. S., et al. (2025). Genome Assembly of Arctica islandica, the Longest-Lived Non-Colonial Animal Species. Animals, 15(5), 690. https://www.mdpi.com/2076-2615/15/5/690
- Nielsen, J., et al. (2016). Eye lens radiocarbon reveals centuries of longevity in the Greenland shark (Somniosus microcephalus). Science, 353(6300), 702–704. https://doi.org/10.1126/science.aaf1703
- Firsanov, D., et al. (2025). Evidence for improved DNA repair in long-lived bowhead whale. Nature. https://doi.org/10.1038/s41586-025-09694-5
- Ledford, H. (2025). This whale lives for centuries: its secret could help extend human lifespan. Nature News. https://www.nature.com/articles/d41586-025-03511-9
- Siddiqui, R., Soares, N. C., & Khan, N. A. (2021). Crocodile Gut Microbiome Is a Potential Source of Novel Bioactive Molecules. ACS Pharmacology & Translational Science. PDF
- Earth.com (2025). 124-year-old crocodile challenges everything we know about aging. Link
- Cell (2023). Distinct longevity mechanisms across and within species. Link
- Longevity Breakthrough: New Treatment Reverses Multiple Hallmarks of Aging – MD Anderson Cancer Center (2024)
- CRISPR Clinical Trials: A 2025 Update – Innovative Genomics Institute
- Frontiers in Cardiovascular Medicine (2025) – Targeting the Hallmarks of Aging
- Aging and Disease (2025) – Single-Cell Multi-Omics in Aging Biolog
- Sayyad, K. K. (2025). Nanorobotics in Cancer Treatment: A Study. International Journal of Nanomaterials and Nanostructures, 11(1). PDF
- eidt, A. (2025). How nanobots are accelerating cancer-targeting therapies. Nature. https://www.nature.com/articles/d41586-025-03480-z
- You, W. et al. (2025). Selenium nanoparticle-delivered MDM2 inhibitor reactivates p53 and reprograms tumor immune microenvironment in colorectal cancer. Frontiers in Immunology, 16. https://www.frontiersin.org/articles/10.3389/fimmu.2025.1684611/ful
